2024年2月11日
2024年2月12日
A.ECMOフローとImpella補助レベルを上げて、心筋酸素消費量を少なくする方法。モニター上の脈圧が消えている(LVESPと大動脈圧のピークが一致しなくなる)状態。大動脈弁が全周期を通じて閉じている。
コメント:
式:Ao圧-LVP=圧較差
圧較差はImpellaではモーターの消費電力推定可能
Ao圧はImpellaが直接測定
以上より、LVPの推定が可能となる。
このLVPについて目標値をどうするか?ということは決まっていないが、15mmHg以下で可能な限り低い数字、ということになるだろう。
また、ECMO/Impellaフローについては合併症ない範囲でTotalサポートとしておくが、その流量については尿量やカテコラミンが切れるか、乳酸値など全身評価を行う。
(施設によってはTotal MCS flow index:(ECMO flow+Impella flow)/BSA≧2.2を使用するところもあるようだ。このインデックスの生理的な説明は自分はできない)
なお、その昔、聴講した講演で、他施設でβ遮断薬を最大化してHRを可能な限り下げるという戦略もあるらしい。こういった管理は自分では行ったことはない。理由はβ遮断薬使用すると心機能が擬似的に抑えられた結果、改善が分かりにくくてなんとなく管理しにくそうというイメージがあるから。自分の臨床が変わるかは研究結果を待つ。
あと、ECpellaのTotalサポートであっても、主治医によっては”左室内で血栓を作るのが嫌だから、脈圧を出すためにDOBを使用してください”という人もいるが、良い戦略とは思えない。
A.正解はない。実際には具体的にはカテコラミンを離脱して心機能が立ち上がり傾向を見せるまで我慢のTotalサポートフェーズ、立ち上がり傾向と思ったあと離脱を見据えたPartialサポートフェーズとして切り分けている。
コメント:
ImpellaはECMOに対する左室Ventという役割があり、左心補助のためにECMOと併用されることが多い。PVループを考えると、心筋酸素消費量∝PE+SW であるため心筋補助という観点からは極力Impella補助を増やしつつ、ECMOフローを適正量に保っておく。これが上で述べた通りTotalサポートフェーズである。このフェーズの期間はケースバイケースである。例えばAMI後のVF stormや機械的合併症ハイリスク症例など、開通後72時間はがっちりTotalサポートとすることもある。
ここから問題は、離脱に際してPartialサポートフェーズを挟むべきか?である。
心筋酸素消費量が少ないなら、、Totalサポート中にいきなりSBTみたいにして離脱でいいじゃん、と思うのが自然であろう。
…なのだが、実際には段階的なウィーニングを挟んでいる。
(根拠ないが)理由は、
1.肺機能が問題となっているケースもしばしばあり、人工呼吸器のフェーズと歩調をあわせようとするとPartialにして呼吸機能を見てみよう、と思いたくなる。
2.Total vs Paritalで、Totalを続ける管理で生存率が優れるというエビデンスは知らない
3.Totalサポートにし続けることで、自己心の拡張機能が低下しないのか?という疑問。心臓を常時収縮させておくことは、心筋の廃用につながるのでは?と予想している
4.(主科への配慮)
A.下肢虚血、溶血、出血
下肢虚血:特にImpella挿入部遠位で起こる。順行性シースを挿入してECMO送血管から血液を送る必要がある。
溶血:
溶血で血漿遊離ヘモグロビンが増加→NOを消費して血管収縮+血小板凝集、炎症惹起、沈着によるAKIなどが発生する。
鑑別はImpella位置、右心機能、前負荷、ポンプ流量や血栓など。これ以外にも、溶血性疾患を持っているとか、CHDFなど他の因子の影響もある。50〜70%に発生すると言われる。溶血が起きない範囲で補助レベルを引き下げるが、やむを得ず輸血で耐え凌ぐこともある。
なお、個人的には溶血があるからといってハプトグロビンを投与することはない。
理由は、エビデンス不足に比して薬価が高いため。
心原性ショックでImpellaを6時間以上使用した患者を対象にした後ろ向き研究では、溶血の有無で30日・60日・90日死亡率に差はなかった。72時間でのCreも2.4mg/dL程度で、心原性ショックだけでも十分説明できそうなレベル。
出血:
Ecpellaは剪断力によるフォン・ウィルブランド因子消費+デバイス血栓予防目的のヘパリン±抗血小板薬によって発生しやすい環境にある。
APTTモニタリングを行いつつ、局所の出血ソースコントロールを行う。
A.原疾患の臨床経過、血行動態、エコー所見の3つ。
コメント:
Ecpellaの離脱は肺が問題なければECMOから離脱する。
(右心は問題ないが肺が悪いという状態であればVV-ECMOにコンバートした上でVV-ECMO/Impella→Impellaを先に降りるという選択肢はありうるかもしれない)
ECMO離脱に際しては人工呼吸器離脱と一緒で、原疾患が良くなれば離脱できるか毎日評価し、基準をクリアするなら早々に離脱する。
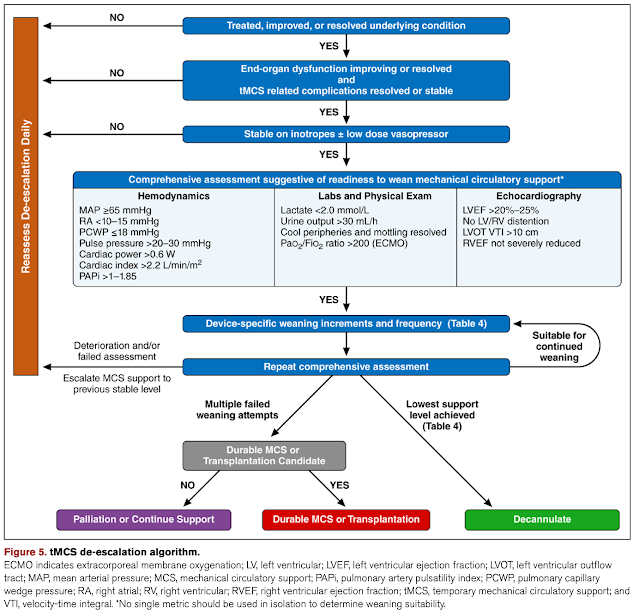
基準については、最良の離脱基準は存在しない。
強いて言えばレビューで提案されているものが近いフローになる。
実際は…
1.原疾患が改善傾向であると思えば、毎日離脱時期について評価を行う。
2.ImpellaをP2-4まで下げた状態で、ECMOフローを1.5Lまで下げる(エコー評価中に限って、1Lまで下げる)。
3.ECMOは右室と呼吸機能をサポートするため、ECMOフローを下げて数分後には右室機能については肺動脈カテーテルパラメーター(PAPi・RAP/PCWP)とエコー(TAPSE)を、呼吸については人工呼吸器パラメーターと右手のガスを評価する。肺動脈カテーテルのパラメーターは有用で、右心が悪い人においては離脱前に挿入しておくことが多い。ImpellaがP2程度であれば、カットオフはPAPi≦0.9かつRAP/PCWP≧0.86で右心の立ち上がりが悪いと判断するが、Impellaのサポートが高ければPAPi≦1.85かつRAP/PCWP≧0.63を採用してもいいかもしれない
4.2〜3時間後に右室機能や肺機能に加えて全体の需給バランスを評価(乳酸値や尿量など)
5.離脱可能なら離脱する。回路分の喪失補充のため赤血球を2〜4単位輸血し、Post ECMO syndromeとImpella刺入部側の下肢血流に注意しておく。離脱不能であれば原疾患の改善を待つ。原疾患の改善がそれ以上見込めないかつ移植が視野に入っていなければ緩和を提案する。
なお、TIDEアルゴリズムなるものも提案されている。
こちらも評価項目や基準は微妙に異なっているが、コンセプトは同じであろう。
以下の条件を満たすことで開始:
カテコラミン使用していない、バイタル安定(適切なHR/MAP/CVP、リズム、発熱なし)、酸素化OK
T:ECMOの流量を最低1.2~1.5L/分に、Impella補助をfull unloadingできている補助レベルで経胸壁心エコー。
(a) 左心機能:LVEF≧30-35%、LVOT VTIが保たれている
(b)肺循環:SPAP、PVRが著しく高くない
(c)右心機能:FAC、自由壁ストレイン、TAPSE
I:Impella補助レベルを1段階ずつ下げながら、バイタルと上記エコー所見をモニター。下げるのに失敗した場合は、full unloadingに戻して8〜24時間後に再度補助レベルを下げ始める。P2まで下げた状況で以下の所見が出ればクリア。クリアしなければ次ステップ。
D:ドブタミン負荷試験で予備能を確認。10〜40γでLVEFが5%以上増加(収縮予備能)、は一回拍出量が20%以上増加する(フロー予備能)こと。
E:患者が覚醒していればカテーテル検査中にハンドグリップによる運動負荷試験でパラメーター(CI、PAP、PCWP、PVRの運動前後での変化)を確認。
A.血管抵抗、心拍数。
圧=抵抗(R)×流量(F)なので、平均動脈圧(MAP)=R×F
この計算式上ではMAPは定常流を想定しているものなので、
収縮期動脈圧(Pes)=平均動脈圧(MAP)=拡張期動脈圧と捉えてOK。
MAP=R×CO
Pes=R×CO
Pes=R×HR×SV
である。
ここで、Pes=傾き×SVであることから(P=傾き×Vという式)
傾きに相当するのが、HRとRであることが分かる。
・全ての見たことがないデバイスは、その原理と挿入の適応がわかっていれば離脱の判断は可能である。あとは人工呼吸と一緒で、毎日離脱可能かどうかを判断するだけである。
・機械的心サポート中の右心機能がどれくらい立ち上がったのか?を見極めるのは難しい。概ねAMI絡みであるが、まだ虚血から立ち上がっている最中なのか?と悩んでいる最中にカテ感染を起こすと最悪である。意外とこの程度の右心機能パラメーターでも離脱できるんや…と思うときもあれば、パラメーターよかったのにへばったのか…?と再クラッシュすることもある。
・後ろ向き観察研究3つが組み入れられたメタ解析ではインペラによる左室Unload戦略の死亡率改善を認めなかった(RR0.78, 95%CI 0.55-1.1)(J Am Coll Cardiol 2019;73:654–62)。しかし、管理技術の向上やデバイスの改善次第ではRR0.7前後に収束していくように思う。
Unoki T, Saku K, Kametani M, et al. Impella Motor Current Amplitude Reflects the Degree of Left Ventricular Unloading under ECPELLA Support. Int Heart J. 2022;63(6):1187-1193.
Van Edom CJ, Gramegna M, Baldetti L, et al. Management of Bleeding and Hemolysis During Percutaneous Microaxial Flow Pump Support: A Practical Approach. JACC Cardiovasc Interv. 2023;16(14):1707-1720.
Badiye AP, Hernandez GA, Novoa I, Chaparro SV. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO J. 2016;62(1):11-14.
Belohlavek J, Hunziker P, Donker DW. Left ventricular unloading and the role of ECpella. Eur Heart J Suppl. 2021;23(Suppl A):A27-A34. Published 2021 Mar 27.
Meani P, Lorusso R, Pappalardo F. ECPella: Concept, Physiology and Clinical Applications. J Cardiothorac Vasc Anesth. 2022;36(2):557-566.
Geller BJ, Sinha SS, Kapur NK, et al. Escalating and De-escalating Temporary Mechanical Circulatory Support in Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 2022;146(6):e50-e68.
Tschöpe C, Spillmann F, Potapov E, et al. The "TIDE"-Algorithm for the Weaning of Patients With Cardiogenic Shock and Temporarily Mechanical Left Ventricular Support With Impella Devices. A Cardiovascular Physiology-Based Approach. Front Cardiovasc Med. 2021;8:563484.
ー記事をシェアするー
登録:
コメントの投稿 (Atom)




コメント
コメントを投稿